НЕПРЕДЕЛЬНЫЕ, ИЛИ НЕНАСЫЩЕННЫЕ,УГЛЕВОДОРОДЫ РЯДА ЭТИЛЕНА (АЛКЕНЫ, ИЛИ ОЛЕФИНЫ)
Алкены, или олефины (от лат. olefiant - масло — старое название, но широко используемое в химической литературе. Поводом к такому названию послужил хлористый этилен, полученный в XVIII столетии, — жидкое маслянистое вещество.) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы(с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общейформулой CnH2n. 1. СТРОЕНИЕ АЛКЕНОВ Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4. Строение его молекулы можно выразить такими формулами:
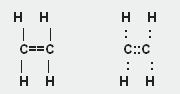
По названию первого представителя этого ряда —этилена — такие углеводороды называют этиленовыми. В этиленовых углеводородах (алкенах) атомы углерода находятся во втором валентном состоянии (sр2-гибридизапия). Напомним, что в этом случае между углеродными атомами возникает двойная связь, состоящая из одной s- и одной p-связи. Длина и энергия двойной связи равны соответственно 0,134 нм и 610 кДж/моль. Разница в энергиях s- и p-связей (610 - 350 = 260)является приблизительной мерой, характеризующей прочность p-связи.Будучи более слабой, она в первую очередь подвергается разрушительному действию химического реагента.
Модели молекулы этилена приведены на рис. 1.

Рис.1. Модели пространственного строения молекулы этилена:
a) тетраэдрическая;
б) шаростержневая;
в) по Бриглебу 2.НОМЕНКЛАТУРА И ИЗОМЕРИЯ Номенклатура. Алкены простого строения часто называют,заменяя суффикс -ан в алканах на -илен:этан — этилен,пропан — пропилен и т.д. По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан —пропен и т.д.). Выбор главной цепи и порядокназвания тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:

3,3-диметилпентен-12,4-диметилгексен-2 Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:
H3C-CH==CH-CH2-CH3
метилэтилэтилен Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С==СН— - винил (этенил) Н2С==CН—СН2-аллил (пропенил-2)
Изомерия. Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов. Первые два члена гомологического ряда алкенов -этилен и пропиле) - изомеров не имеют и их строение можно выразить так: H2C==CH2 H2C==CH—CH3
этилен пропилен
(этен) (пропен) Для углеводорода С4H8возможны три изомера:
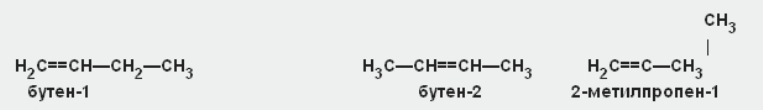
Первые два отличаются между собой положением двойной связи углеродной цепи, а третий —характером цепи (изостроение).
Однако в ряду этиленовых углеводородов помимо структурноq изомерии возможен еще один вид изомерии — цис-,транс-изомерия/
Такая изомерия характерна для соединений с двойной связью. Если простая s-связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических(цис-, транс-)изомеров. Геометрическая изомерия — один из видов пространственной изомерии. Изомеры, у которых одинаковые заместители(при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами,а по разную —транс-изомерами:

Цис-и транс-изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами.
Транс-изомеры более устойчивы, чем цис-изомеры. 3. ПОЛУЧЕНИЕ АЛКЕНОВ В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилен)выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля.Например:
Крекинг алканов:
С2Н6 -> СН2 == СН2 + Н2 (при t)
Дегидрогалогенирование галогеналканов:
СН3 - СН2Br + KOH -> СН2 == СН2 + KBr + H2O (Ппри участии спиртового раствора)
Дегалогенирование дигалагеналканов:
СН2Br - СН2Br + Zn -> ZnBr2 + СН2 == СН2
Дегидротация спиртов:
СН3 - СН2OH -> СН2 == СН2 + H2O (при конц. H2SO4) 4. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА Физические свойства. Физические свойства некоторых алкенов показаны в табл. 1. Первые три представителя гомологического ряда алкенов(этилен, пропилен и бутилен) — газы, начиная с C5H10(амилен, илипентен-1) — жидкости, а с С18Н36—твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры,имеющие изостроение. Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления — наоборот. Алкены плохо растворимы в воде (однако лучше,чем соответствующие алканы), но хорошо — в органических растворителях. Этилен и пропилен горят коптящим пламенем. Таблица 1. Физические свойства некоторых алкенов

* Жидкий Алкены малополярны, но легко поляризуются. Химические свойства. Алкены обладают значительной реакционной способностью. Их химические свойства определяются, главным образом, двойной углерод-углеродной связью. p-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента.Таким образом, при реакциях присоединения двойная связь разрывается как бы наполовину (ссохранением s-связи). Для алкенов, кроме присоединения, характерныеще реакции окисления и полимеризации. Реакции присоединения.
Гидрирование (присоединение водорода).
Алкены, присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды — алканы: Н2С==СН2+ H2 -> Н3С—СН3 Галогенирование(присоединение галогенов).
Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных: Н2С==СН2+ Cl2 -> ClH2C—CH2Cl Легче идет присоединение хлора и брома, труднее — иода. Фтор с алкенами, как и с алканами,взаимодействует со взрывом. Реакцию галогенирования обычно проводят врастворителе при обычнойтемпературе. Присоединение брома к алкенам (реакция бромирования) — качественная реакция на предельные углеводороды.
При пропускании через бромную воду (раствор брома в воде)непредельных углеводородов желтая окраска исчезает (в случае предельных — сохраняется).
СН2==СН2+Br2 -> СН2Br-СН2Br Гидрогалогенирование(присоединение галогеноводородов).
Алкены легко присоединяют галоген водороды:
H2С==СН2+ НВr -> Н3С—CH2Вr Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова (1837—1904):
приобычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а галоген — к менее гидрогенизированному:
СН2==СН2+HCl -> СН3-СН2Cl
СН2==СН2-СН2+HCl -> СН3-СНCl-CH3 Гидратация(присоединение воды).
В присутствии катализаторов [H2SO4(конц.) и др.] к алкенам присоединяется вода с образованием спиртов. Например:
 Реакции окисления.
Алкены окисляются легче,чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
Окисление при обычной температуре.
При действии на этилен водногораствора КМnO(при нормальных условиях) происходит образование двухатомного спирта — этиленгликоля: 3H2C==CH2+2KMnO4+ 4H2O -> 3HOCH2—CH2OH + 2MnO2+ KOH Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения. В более жестких условиях (окисление КМnO4в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов: H3C—CH=|=CH—CH3+ 2O2 -> 2H3C—COOH При окислении этилена кислородом воздуха в присутствии металлического серебра образуется оксид этилена:
Горение алкенов.
Как и алканы, непредельные соединения ряда этилена сгорают на воздухе с образованием оксида углерода (IV) и воды: Н2С=СН2+ 3O2 -> 2СO2+ 2Н2O Реакция изомеризации.
При нагревании или в присутствии катализаторов алкены способны изомеризоваться — происходит перемещение двойной связи или установление изостроения. Реакции полимеризации.
За счет разрыва p-связей молекулы алкена могут соединяться друг с другом, образуя длинные цепные молекулы.
5. ПРИМЕНЕНИЕ АЛКЕНОВ.
 
6. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ Этилен (этен) Н2С==CН2- газ без цвета и запаха, малорастворимый в воде. Как и метан, с воздухом образует взрывоопасные смеси. Широко используется для получения различных органических веществ: этилового спирта, стирола,галогенпроизводных, полиэтилена, оксида этилена и др. Пропилен (пропен) Н3С—СН==СН2 служит сырьем для получения изопропилбензола, ацетона, фенола, полипропилена, глицерина, изопропиловогоспирта, синтетического каучука и других ценных органических продуктов. Бутилены (бутен-1 и бутен-2), изобутилен(3-метилпропен-1)C4H8. Бутен-1 применяется для получения дивинила и изооктана, а бутен-2 — в качестве среды при полимеризации дивинила. Из изобутилена получают изооктан, изопропен и полиизобутилен.
| 









